Trójwymiarowy model naczynia nowotworowego na chipie, pokazujący komórki raka trzustki (zielone) atakujące sztuczne naczynie krwionośne (czerwone) poprzez rozbicie błony podstawnej naczynia (żółtej).
Badania przeprowadzone pod kierownictwem Cornell University ujawniły, w jaki sposób śmiertelna postać raka trzustki przedostaje się do krwiobiegu, rozwiązując długotrwałą zagadkę dotyczącą rozprzestrzeniania się tej choroby i identyfikując obiecujący cel terapii.
Gruczolakorak przewodowy trzustki jest jednym z najbardziej śmiertelnych nowotworów, a mniej niż 10% pacjentów przeżywa pięć lat od diagnozy. Jego mikrośrodowisko to gęsta, zwłókniona tkanka, która działa jak pancerz wokół guza. Bariera ta utrudnia podawanie leków i teoretycznie powinna zapobiegać rozprzestrzenianiu się guza. Jednak rak daje przerzuty z zaskakującą skutecznością — paradoks, który intryguje naukowców.
Nowe badania opublikowane w czasopiśmie Molecular Cancer ujawniają, że odpowiedzialny za to jest receptor biologiczny o nazwie ALK7, który aktywuje dwie powiązane ze sobą ścieżki, działające wspólnie. Jedna z nich zwiększa mobilność komórek nowotworowych poprzez proces zwany przemianą nabłonkowo-mezenchymalną, a druga wytwarza enzymy, które fizycznie rozkładają ściany naczyń krwionośnych.
„Innymi słowy, ALK7 daje komórkom raka trzustki zarówno silnik do poruszania się, jak i narzędzia do inwazji” – powiedział Esak Lee, główny autor badania i adiunkt w Meinig School of Biomedical Engineering w Cornell Engineering.
Badania pomagają rozwiązać sprzeczne wyniki dotyczące ALK7, które w niektórych badaniach wiązano z blokowaniem rozprzestrzeniania się raka, a w innych z jego napędzaniem. Korzystając z mysich modeli raka trzustki i zaawansowanych systemów organ-on-chip, które naśladują ludzkie naczynia krwionośne, naukowcy wykazali, że blokowanie ALK7 znacznie spowalnia przerzuty.
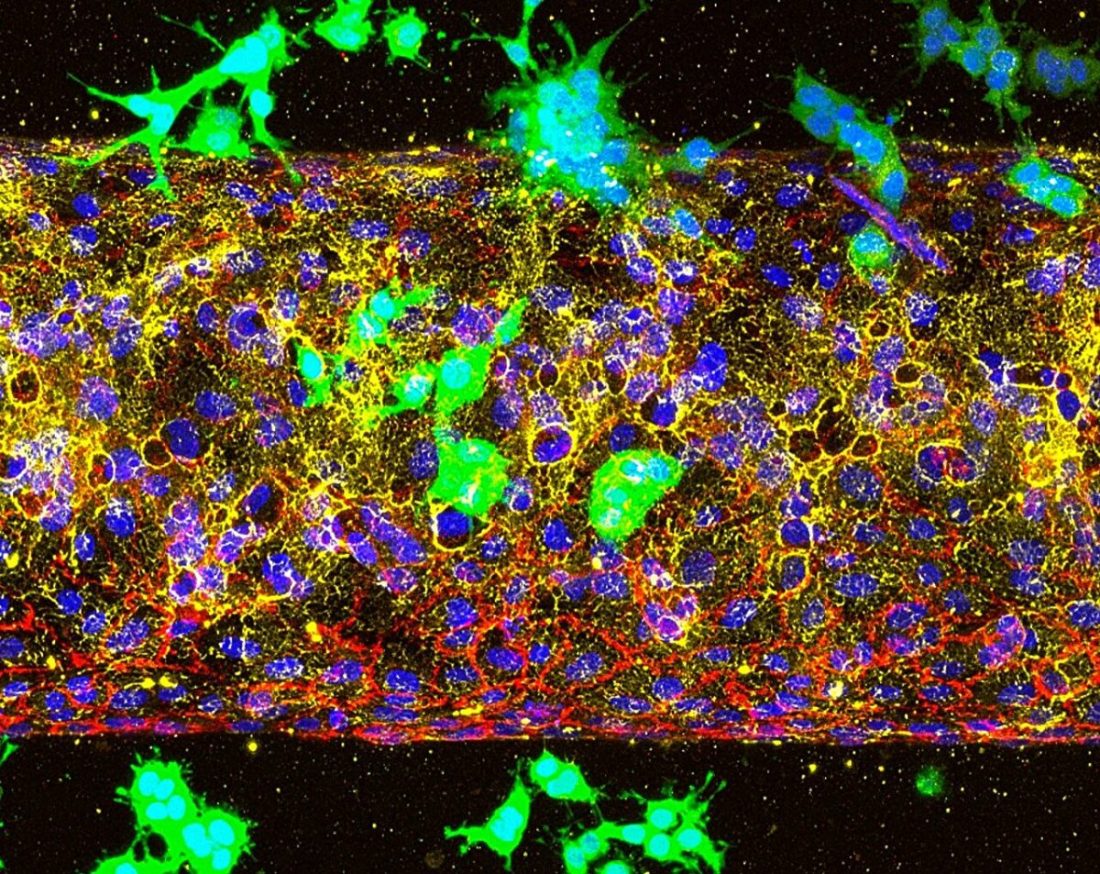
System organ-on-chip, opracowany w laboratorium Lee, symuluje mikrośrodowisko guza i jest lepszy od modeli zwierzęcych do badania różnych stadiów raka. Wykorzystując go, naukowcy zbadali, czy ALK7 napędza początkową inwazję naczyń krwionośnych, czy też późniejsze stadium, kiedy krążące komórki nowotworowe opuszczają krwiobieg, aby utworzyć nowe guzy w narządach, takich jak płuca lub wątroba.
Odkryli, że komórki nowotworowe nie mogły dostać się do naczyń krwionośnych, gdy ALK7 był zahamowany. Jednak gdy naukowcy naśladowali późniejszy etap raka, umieszczając komórki wewnątrz naczyń, rozprzestrzeniały się one szybko, co wskazuje, że czas leczenia ma kluczowe znaczenie.
„Gdy przegapimy tę wczesną okazję do zablokowania receptorów ALK7, komórki nowotworowe mogą swobodnie krążyć w krwiobiegu i łatwo rozprzestrzeniać się do innych narządów” – powiedział Lee. „Jeśli jednak uda nam się zahamować ALK7 na najwcześniejszym i najbardziej wrażliwym etapie raka, możemy osiągnąć lepsze wyniki leczenia pacjentów”.
Badanie podkreśla również potencjał zastosowania platform organ-on-chip do badania innych rodzajów nowotworów lub sposobu, w jaki komórki odpornościowe infiltrują naczynia i opuszczają je.
„Niektóre nowotwory mają bardzo różne mikrośrodowiska, więc potencjalnie ALK7 może wykazywać różne skutki” – powiedział Lee. „Mam nadzieję, że to badanie naprawdę otworzy nową drogę dla badań nad rakiem”.